-
-
-
Tổng tiền thanh toán:
-

Đề thi chuyên hóa vào lớp 10 chuyên Vĩnh Phúc chuyên Lam Sơn
07/05/2021 Đăng bởi: cầu Công ty cổ phần CCGroup toàn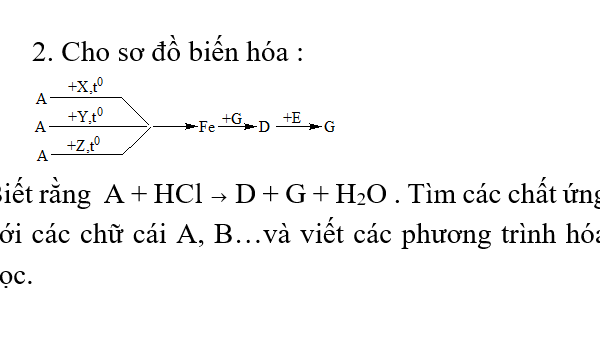
Tuyển tập đề thi chuyên hóa vào lớp 10 chuyên Vĩnh Phúc và chuyên Lam Sơn – Thanh Hóa dành cho học sinh lớp 9 muốn thi vào khối chuyên Hóa
Xem thêm: Đề thi chuyên Anh HN - Ams có đáp án chi tiết
Gợi ý tài liệu ôn thi tuyển sinh vào lớp 10
Bộ sách ôn thi vào 10 cấp tốc: Đột phá 9+
Đồng giá 150k/ cuốn: Bí quyết chinh phục điểm cao lớp 9: Tổng ôn toàn bộ kiến thức lớp 9 cấp tốc, cầm chắc 9 điểm/ môn thi vào 10
Bộ sách ôn thi vào trường CHUYÊN đỉnh nhất
1, Chữa chi tiết đề thi chuyên Hóa vào lớp 10 chuyên Vĩnh Phúc
Phần đề thi chuyên hóa vào lớp 10 chuyên Vĩnh Phúc
Câu 1 (2,5 điểm)
1, Một hỗn hợp X gồm các chất: K2O, KHCO3, NH4Cl, BaCl2 có số mol mỗi chất bằng nhau. Hoà tan hỗn hợp X vào nước, rồi đun nhẹ thu được khí Y, dung dịch Z và kết tủa M. Xác định các chất trong Y, Z, M và viết phương trình phản ứng minh họa.
2, Cho sơ đồ biến hóa
 Câu 1 phần 2
Câu 1 phần 2
Biết rằng A + HCl -> D + G + H2O. Tìm các chất ứng với các chữ cái A, B,… và viết các phương trình hóa học.
Câu 2 đề thi chuyên hóa vào lớp 10 chuyên Vĩnh Phúc:
1, Hòa tan 3,38 gam oleum X vào lượng nước dư ta được dung dịch A. Để trung hòa 1/20 lượng dung dịch A cần dùng 40 ml dung dịch NaOH 0,1 M . Tìm công thức của oleum.
2, Chỉ được dùng thêm 1 thuốc thử và các ống nghiệm, hãy trình bày phương pháp hóa học nhận ra các dung dịch bị mất nhãn NaHSO4, Na2CO3, NaCl, BaCl2, Na2S.
Câu 3. (1,5 điểm)
1, Polime X chứa 38,4% cacbon; 56,8% clo và còn lại là hydro về khối lượng. Xác định công thức phân tử, viết công thức cấu tạo của X và gọi tên, cho biết trong thực tế X dùng để làm gì?
2, Từ metan và các chất vô cơ cần thiết khác. Hãy viết các phương trình phản ứng hoá học (ghi rõ điều kiện) để điều chế X nói trên.
Câu 4 đề thi chuyên hóa vào lớp 10 chuyên Vĩnh Phúc (2 điểm)
Cho 6,72 lít hỗn hợp khí gồm một ankan và một olefin đi qua dung dịch Brom thấy khối lượng bình Brom tăng 4,2 gam và thoát ra 4,48 lít khí. Đốt cháy khí thoát ra thu được 8,96 lít khí CO2. Xác định công thức phân tử của các hiđrocacbon, biết thể tích các khí đo ở đktc.
Câu 5. (2 điểm)
Hòa tan hoàn toàn 9,18 gam Al nguyên chất cần V lít dung dịch axit HNO3, nồng độ 0,25M, thu được một khí X và một dung dịch muối Y. Biết trong X số nguyên tử của nguyên tố có sự thay đổi số oxi hóa là 0,3612.1023 (số Avogadro là 6,02.1023). Để phản ứng hoàn toàn với dung dịch Y tạo ra một dung dịch trong suốt cần 290 gam dung dịch NaOH 20%.
1, Xác định khí X và viết các phương trình phản ứng xảy ra?
2, Tính V?
Phần đáp án chi tiết đề thi chuyên hóa vào lớp 10 chuyên Vĩnh Phúc
Câu 1
1,

Đáp án câu 1 ý 1
2, Vì A + HCl -> D + G + H2O và A bị khử thành Fe nên A là Fe3O4; D là FeCl2; E là Cl2; G là FeCl3.
Các chất khử X là H2, Y là CO, Z là C
Các phương trình hoá học:
1) Fe3O4 + 4H2 -> 3Fe + 4H2O
2) Fe3O4 + 4CO -> 3Fe + 4CO2
3) Fe3O4 + 2C -> 3Fe + 2CO2
4) Fe + 2FeCl3 -> 3FeCl2
5) 2FeCl2 + Cl2 -> 2FeCl3
Câu 2 đề thi chuyên hóa vào lớp 10 chuyên Vĩnh Phúc
1,

Đáp án câu 2 ý 1
2, Dùng Zn nhận ra NaHSO4 do có bọt khí tạo thành
PTHH: Zn + NaHSO4 -> ZnSO4 + Na2SO4 + H2
Dùng NaHSO4 để nhận ra BaCl2 do tạo thành kết tủa trắng của BaSO4, nhận ra Na2S do tạo thành khí có mùi trứng thối (H2S)
PTHH: 2NaHSO4 + BaCl2 -> Na2SO4 + HCl + BaSO4
2NaHSO4 + Na2S -> 2 Na2SO4 + H2S
Dùng BaCl2 để nhận ra Na2CO3 do tạo thành kết tủa trắng của BaCO3
PTHH: BaCl2 + Na2CO3 -> BaCO3 + 2NaCl
còn lại là dd NaCl.
Câu 3
1,

Đáp án câu 3 ý 1
2, 2CH4 -> CH ≡ CH + 2H2 (1500 độ C, lln)
CH ≡ CH + HCl -> CH2 = CHCl
n(CH2=CHCl) -> (-CH2-CHCl)n (PVC)
Câu 4 đề thi chuyên hóa vào lớp 10 chuyên Vĩnh Phúc

Đáp án câu 4
Câu 5

Đáp án câu 5
2, Chữa chi tiết đề thi chuyên Hóa vào lớp 10 chuyên Lam Sơn – Thanh Hóa
Đề thi chuyên hóa vào lớp 10 chuyên Lam Sơn – Thanh Hóa
Câu 1. (2,75 điểm)
1, Chỉ dùng một hoá chất, trình bày cách phân biệt: Kaliclorua, amoninitrat và supephotphat kép.
2, Cho hỗn hợp A gồm Mg, Fe vào dung dịch B gồm Cu(NO3)2, AgNO3. Lắc đều cho phản ứng xong thu được hỗn hợp rắn C gồm 3 kim loại và dung dịch D gồm 2 muối. Trình bày phương pháp tách từng kim loại ra khỏi hỗn hợp C và tách riêng từng muối ra khỏi dung dịch D.
3, a/ Từ nguyên liệu là quặng apatit, quặng pirit, các chất vô cơ và điều kiện cần thiết, hãy viết các phương trình hoá học biểu diễn các phản ứng điều chế supephotphat đơn và supephotphat kép.
b/ Trong phòng thí nghiệm có hỗn hợp Na2CO3.10H2O và K2CO3 (các phương tiện, hóa chất cần thiết có đủ). Bằng cách nào xác định được % khối lượng các chất trong hỗn hợp trên.
Câu 2 đề thi chuyên hóa vào lớp 10 chuyên Lam Sơn – Thanh Hóa:

Đề câu 2 ý 1
2, Có 3 chất lỏng là rượu etylic, benzen và nước. Trình bày phương pháp đơn giản để phân biệt chúng.
3, Hợp chất hữu cơ A mạch hở chứa C, H, O có khối lượng mol bằng 60 gam. Tìm công thức phân tử , viết các công thức cấu tạo ứng với công thức phân tử của A. Xác định công thức cấu tạo đúng của A, biết rằng A tác dụng được với NaOH và với Na kim loại.
Câu 3 đề thi chuyên hóa vào lớp 10 chuyên Lam Sơn – Thanh Hóa (3,0 điểm )
1, A là axit hữu cơ mạch thẳng, B là rượu đơn chức bậc một, có nhánh. Khi trung hoà hoàn toàn A thì số mol NaOH cần dùng gấp đôi số mol A. Khi đốt B tạo ra CO2 và nước có tỷ lệ số mol tương ứng là 4:5. Khi cho 0,1 mol A tác dụng với B, hiệu suất 73,5% thu được 14,847 gam chất hữu cơ E. Xác định công thức cấu tạo của A, B, E.
2, Một hỗn hợp X gồm hai chất hữu cơ C, D mạch hở không tác dụng với dung dịch Br2 và đều tác dụng với dung dịch NaOH. Tỷ khối hơi của X đối với H2 bằng 35,6.
Cho X tác dụng hoàn toàn với dung dịch NaOH thì thấy phải dùng 4 gam NaOH, phản ứng cho ta một rượu đơn chức và hai muối của axit hữu cơ đơn chức. Nếu cho toàn thể lượng rượu thu được tác dụng với Na dư có 672ml khí (đktc) thoát ra. Xác định CTPT và CTCT của C, D.
Câu 4 đề thi chuyên hóa vào lớp 10 chuyên Lam Sơn – Thanh Hóa (1,5 điểm)
Chất A là một loại phân đạm chứa 46,67% nitơ. Để đốt cháy hoàn toàn 1,8 gam A cần 1,008 lít O2 (ở đktc). Sản phẩm cháy gồm N2, CO2, hơi H2O, trong đó tỷ lệ thể tích VCO2 / VH2O = 1:2
1, Xác định công thức phân tử, viết công thức cấu tạo của A. Biết rằng công thức đơn giản nhất của A cũng là công thức phân tử.
2, Trong một bình kín dung tích không đổi 11,2 lít chứa O2 (đktc) và 0,9 gam A. Sau khi đốt cháy hết chất A, đưa bình về nhiệt độ ban đầu.
a/ Tính thể tích các chất thu được sau phản ứng (ở đktc).
b/ Cho tất cả khí trong bình đi từ từ qua 500ml dung dịch NaOH 20% (d=1,2g/ml). Tính nồng độ % của các chất trong dung dịch thu được, biết rằng khi cho khí qua dung dịch NaOH thì nước bay hơi không đáng kể.
Cho: Na=23; C=12; H=1; O=16; N=14
Đáp án đề thi chuyên hóa vào lớp 10 chuyên Lam Sơn – Thanh Hóa
Câu 1.
1, Dùng nước vôi trong phân biệt được 3 chất:
+ KCl không phản ứng
+ NH4NO3: tạo ra khí NH3
+ 2NH4NO3 + Ca(OH)2 -> Ca(NO3)2 + 2NH3 + 2H2O
+ Supephotphat tạo kết tủa Ca3(PO4)2:
Ca(H2PO4)2 + 2Ca(OH)2 -> Ca3(PO4)2 + 4H2O
2, Cho A vào B:
Mg + 2AgNO3 -> Mg(NO3)2 + 2Ag
Mg + Cu(NO3)2 -> Mg(NO3)2 + Cu
Fe + 2AgNO3 -> Fe(NO3)2 + 2Ag
Fe + Cu(NO3)2 -> Fe(NO3)2 + Cu
Chất rắn C: Ag, Cu, Fe dư
Dung dịch D: Mg(NO3)2 , Fe(NO3)2
+ Chất rắn C tác dụng với HCl dư: Fe + 2HCl -> FeCl2 + H2
=> Dung dịch thu được chứa FeCl2 và HCl dư, chất rắn gồm Cu, Ag.
Cho Cl2 dư đi qua dung dịch chứa FeCl2 và HCl: Cl2 + 2FeCl2 -> 2FeCl3
Dung dịch thu được cho tác dụng với NaOH dư, lọc lấy kết tủa, nung kết tủa và dùng H2 dư khử thu được Fe:
HCl + NaOH -> NaCl + H2O
FeCl3 + 3NaOH -> Fe(OH)3 + 3NaCl
2Fe(OH)3 -> Fe2O3 + 3H2O
Fe2O3 + 3H2 -> 2Fe + 3H2O
Cho hỗn hợp chất rắn Cu, Ag tác dụng với oxi dư ở nhiệt độ cao:
2Cu + O2 -> 2CuO
Chất rắn thu được gồm CuO và Ag cho tác dụng với HCl dư thu được Ag không phản ứng.
CuO + 2HCl -> CuCl2 + H2O
Điện phân CuCl2 thu được Cu.
+ Cho Mg dư tác dụng với dung dịch D: Mg + Fe(NO3)2 -> Mg(NO3)2 + Fe
Lọc lấy dung dịch và cô cạn thu được Mg(NO3)2.
Hỗn hợp rắn gồm Mg và Fe cho tác dụng với dung dịch Fe(NO3)2 để loại hết Mg
Cho Fe tác dụng với Fe(NO3)3 hoặc AgNO3 thu được Fe(NO3)2
Fe + 2 Fe(NO3)3 -> 3 Fe(NO3)2
3, a/ đề thi chuyên hóa vào lớp 10 chuyên Lam Sơn – Thanh Hóa
Từ FeS2 điều chế H2SO4
4 FeS2 + 11 O2 -> 2 Fe2O3 + 8 SO2
2 SO2 + O2 -> 2SO3
SO3 + H2O -> H2SO4
+ Điều chế supephôtphat đơn: Ca3(PO4)2 + 2H2SO4 -> 2CaSO4 + Ca(H2PO4)2
+ Điều chế H3PO4: Ca3(PO4)2 + 3 H2SO4 -> 3CaSO4 + 2 H3PO4
+ Điều chế supephôtphat kép: Ca3(PO4)2 + 4H3PO4 -> 3Ca(H2PO4)2
b/ Lấy m1 gam hỗn hợp (đã xác định) hòa tan vào nước được dung dịch D gồm Na2CO3, K2CO3.
Cho dung dịch CaCl2 dư vào D. Lấy kết tủa rửa sạch, làm khô cân được khối lượng m2.
Na2CO3 + CaCl2 -> 2NaCl + CaCO3
K2CO3 + CaCl2 -> 2KCl + CaCO3
Lượng Na2CO3.10H2O là a gam thì K2CO3 là (m1-a) gam, do đó:
100a/286 + 100(m1-a)/138 = m2
Vì m1, m2 đã được xác định nên a xác đinh được.
% m(Na2CO3 .10H2O) = a.100%/m1 ; % m(K2CO3 ) = (m1- a).100%/m1
Câu 2 đề thi chuyên hóa vào lớp 10 chuyên Lam Sơn – Thanh Hóa
1, X là chất hữu cơ tác dụng với nước tạo ra CH3CHO => X là CH ≡ CH.
CH ≡ CH + H2O -> CH2 = CHOH (xúc tác H2SO4 tại nhiệt độ 80 độ C) -> CH3CHO. Từ đó suy ra
(1): CH ≡ CH + HCl -> CH2=CHCl
CH2=CHCl+H2O->CH2=CH-OH-> CH3CHO
(2): CH2 = CHCl + HCl -> CH3-CHCl2.
CH3-CHCl2 + 2H2O -> CH3-CH(OH)2 + 2HCl
CH3-CH(OH)2 -> CH3CHO + H2O
(3): CH ≡ CH + RCOOH -> RCOOCH = CH2
RCOOCH = CH2 + H2O -> RCOOH + CH2=CH-OH
CH2=CH-OH -> CH3CHO
(4) RCOOCH=CH2 + HCl -> RCOO-CHCl-CH3
RCOO-CHCl-CH3 + 2H2O -> HCl + RCOOH + CH3-CH(OH)2
CH3-CH(OH)2 -> CH3CHO + H2O
2, Hoà tan trong nước nhận ra benzen do phân thành 2 lớp. 2 chất còn lại đem đốt, nếu cháy đó là rượu, còn lại là nước.
3 đề thi chuyên hóa vào lớp 10 chuyên Lam Sơn – Thanh Hóa
Gọi CTPT của A là CxHyOz
+ Khi z = 1 ta có 14 x + y = 44 => x= 3; y= 8. CTPT của A là C3H8O
Các CTCT: CH3-CH2-CH2OH; CH3-CH(OH)-CH3, CH3-CH2-O-CH3
+ Khi z = 2 ta có 14 x + y = 28 => x= 2; y= 4. CTPT của A là C2H4O2
Các CTCT: CH3- COOH; HO-CH2-CHO; HCOOCH3
+ Khi z = 3 thì 14 x + y = 12 (loại)
Trong các chất trên chỉ có CH3 - COOH tác dụng với cả NaOH và Na
CH3- COOH + NaOH -> CH3- COONa + H2O
CH3- COOH + Na -> CH3- COONa + 1/2 H2
Vậy A là CH3- COOH
Câu 3 đề thi chuyên hóa vào lớp 10 chuyên Lam Sơn – Thanh Hóa
1, Khi trung hòa cần số mol NaOH gấp đôi số mol A, vậy A là axit 2 chức.
Đốt rượu B cho n(H2O) > n(CO2) nên B là rượu no đơn chức bậc 1 CnH2n+2 O
Phương trình đốt cháy: CnH2n+2 O + 1,5n O2 -> nCO2 + (n+1) H2O (1)
Theo (1) và đề ra: n/(n+1) = 4/5 => n=4.
Công thức rượu B là C4H9OH. CTCT: CH3-CH(CH3)-CH2OH
Phương trình hóa học dạng tổng quát
R(COOH)2 + xC4H9OH -> R(COOH)2-x(COOC4H9)x + xH2O
M(E) = 14,847.100/ 73,5.0,1 = 202 đvc
Từ CT của este E ta có: R + 45(2-x) + 101x = 202 => R=112-56x (x=1, x=2)
+ Khi x=1 => R=56 => A là C4H8(COOH)2 => E là C4H8(COOH)(COOC4H9)
+ Khi x=2 => R=0 => A là (COOH)2 => E là (COO)2(C4H9)2
2,

Đáp án câu 3 ý 2
Câu 4

Đáp án câu 4[/caption]
Mới! CC Thần tốc luyện đề 2022 giải pháp giúp sĩ tử TĂNG ĐIỂM CHẮC CHẮN TRONG THỜI GIAN NGẮN (12/01/2022)
Đột phá 8+ phiên bản mới nhất có gì khác biệt so với phiên bản cũ? (21/08/2021)
Giới thiệu bộ sách Đột phá 8+ phiên bản mới dành riêng cho 2K4 (03/08/2021)
Đề thi và đáp án đề thi THPT Quốc gia 2021 môn GDCD (08/07/2021)
